Nội dung chính
- 1 Phân tử là gì lớp 8? Ví dụ
- 2 Kích thước phân tử như thế nào?
- 3 Công thức phân tử là gì?
- 4 cân nặng phân tử là gì?
- 5 Phân tử khối và cách tính phân tử khối của 1 chất
- 6 Liên kết phân tử là gì lớp 6?
- 7 Phương trình phân tử là gì?
- 8 Sự khác nhau giữa nguyên tử và phân tử là gì?
- 9 Một số khái niệm khác liên quan đến phân tử
Chúng tôi rất vui được chia sẻ kiến thức sâu sắc về từ khóa Phân tử là gì? Cách viết công thức tính phân tử – hút ẩm. Bài viết cong thuc phan tu tập trung giải thích ý nghĩa, vai trò và ứng dụng của từ khóa này trong tối ưu hóa nội dung web và chiến dịch tiếp thị. Chúng tôi cung cấp phương pháp tìm kiếm, phân tích từ khóa, kèm theo chiến lược và công cụ hữu ích. Hy vọng thông tin này sẽ giúp bạn xây dựng chiến lược thành công và thu hút người dùng.
Phân tử là một trong những nội dung kiến thức vô cùng quan trọng trong chương trình hóa học. Vậy phân tử là gì? cấu tạo và công thức tính phân tử là gì? Cùng chúng tôi đi tổng hợp và hệ thống lại toàn bộ các kiến thức liên quan đến phân tử nhé!
Bạn Đang Xem: Phân tử là gì? Cách viết công thức tính phân tử – hút ẩm
Phân tử là gì lớp 8? Ví dụ
&o năm 1811, Avogadro đã lần đầu nói về phân tử và khi xuất hiện nó đã gây nên nhiều tranh luận trong cộng đồng hóa học. Và phải đến năm 1911, Perrin công khai về kết quả nghiên cứu của mình, từ đó thuyết phân tử hiện đại mới được sử dụng phổ biến, và được ứng dụng trong ngành hóa học tính toán thời điểm đó.

Phân tử là gì cho ví dụ? – Theo định nghĩa phân tử là gì hóa 8 thì: Phân tử là 1 nhóm trung hòa điện tích, có nhiều hơn 2 nguyên tử kết hợp với nhau bằng những liên kết hóa học. Các phân tử sẽ được phân biệt với ion do thiếu điện tích. Tuy nhiên, trong vật lý lượng tử, hóa học hữu cơ và hóa sinh, nên khái niệm phân tử được sử dụng nghiêm ngặt hơn và áp dụng cho những ion đa nguyên tử.
Trong thuyết động học của chất khí, định nghĩa phân tử được sử dụng cho bất kỳ hạt khí nào, kể cả thành phần của nó. Và theo khái niệm này, các nguyên tử khí trơ sẽ được coi là các phân tử bởi chúng là các phân tử của đơn tử.
VD: Cụ thể về 1 phân tử điển hình là phân tử nước. Phân tử nước là sự kết hợp của 2 nguyên tử Hidro (H+) và 1 nguyên tử Oxy (O2-) => Công thức hóa học của nước sẽ là H2O. Kích thước của phân tử này siêu nhỏ, nên nước dễ thẩm thấu &o da.
Kích thước phân tử như thế nào?

Hầu hết các phân tử đều có kích thước cực nhỏ và khó có thể nhìn thấy bằng mắt thường. Những phân tử này thường được dùng làm các khối xây dựng để tổng hợp hữu có có kích thước từ 1 &i cho đến &i chục angstroms (Å) hay khoảng 1 phần tỷ mét.
Những phân tử đơn lẻ không thể quan sát được bằng ánh sáng, nhưng nó có thể nhìn được nếu sử dụng kính hiển vi lực nguyên tử. Với thiết bị này, ta có thể tìm được các phân tử nhỏ, thậm chí đường viền của các phân tử riêng lẻ trong 1 số trường hợp.
Những phân tử lớn nhất được gọi là siêu phân tử hay đại phân tử; và phân tử bé nhất là hydro diatomic (H2).
Công thức phân tử là gì?
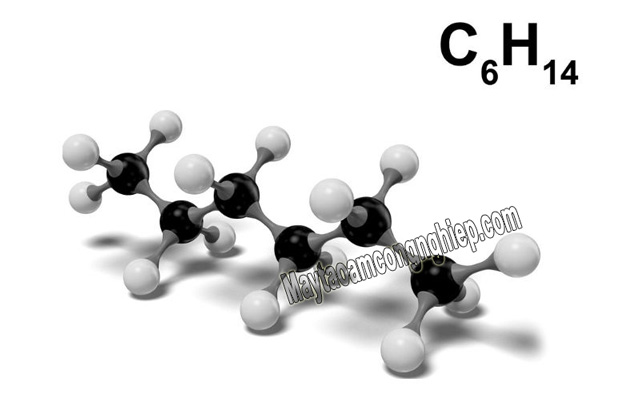
Công thức phân tử là biểu thức cho biết số lượng và loại nguyên tử có trong phân tử của 1 chất. Ví dụ, trong phân tử Hexan có 6 nguyên tử C và 14 nguyên tử H, công thức phân tử sẽ là C6H14.
cấu trúc phân tử và công thức công tử là 2 yếu tố quan trọng quyết định tới tính chất của nó, đặc biệt là bản lĩnh phản ứng của nó.
cân nặng phân tử là gì?
cân nặng phân tử là tổng cân nặng nguyên tử tương đối của từng nguyên tố cấu thành nhân với số lượng nguyên tố trong công thức phân tử. trọng lượng của các phân tử có kích thước từ nhỏ đến trung bình và được đo bằng phép đo phổ khối và phép đo lượng hóa.
Đối với những phân tử lớn như protein, các phương pháp trên dựa trên độ nhớt, sự tán xạ ánh sáng và có thể được sử dụng để xác định khối lượng phân tử khi không có sẵn dữ liệu tinh thể.
Phân tử khối và cách tính phân tử khối của 1 chất

Phân tử khối là gì?
Xem Thêm : Việt vị là gì? Lỗi việt vị và cách hiểu về luật việt vị đúng đắn?
Phân tử khối là khối lượng của nguyên tử được tính theo đơn vị Cacbon. Và phân tử khối của 1 chất sẽ bằng tổng nguyên tử khối của toàn bộ nguyên tử có trong phân tử chất đó.
VD: Phân tử khối của Oxi (O2) là: 8.2 = 16 (đvC)
Cách tính phân tử khối của hợp chất như nào?
Để tính phân tử khối của hợp chất ta sẽ thực hiện theo 3 bước sau:
- Xác định nguyên tử khối của từng nguyên tố dựa &o ký hiệu hóa học
- Nhân nguyên tử khối với số khối của nguyên tố tương ứng
- Công tích các số của nguyên tử khối làm ở bước 2 lại với nhau.
Một phân tử được tạo thành từ x nguyên tử A, y nguyên tử B thì sẽ được tính theo công thức sau:
Phân tử khối = a . x + b . y (trong đó a, b là nguyên tử khối lần lượt của A và B).
Liên kết phân tử là gì lớp 6?
Liên kết hóa học được hiểu là sự hình thành liên kết giữa 2 hoặc nhiều phân tử, nguyên tử, ion để tạo thành các hợp chất hóa học. Những hợp chất hóa học này phụ thuộc &o độ bền của các liên kết hóa học giữa các thành phần. Nếu liên kết giữa các thành phần càng mạnh thì hợp chất tạo thành cũng càng bền vững.
Liên kết giữa các phân tử có 2 loại là liên kết cộng hóa trị và liên kết ion. Có 1 số nguyên tố chỉ được tồn tại trong môi trường ở dạng phân tử, và phân tử của hợp chất được hình thành từ 2 yếu tố trở nên. VD: Hidro luôn tồn tại ở dạng phân tử Hidro (H2).
Liên kết cộng hóa trị
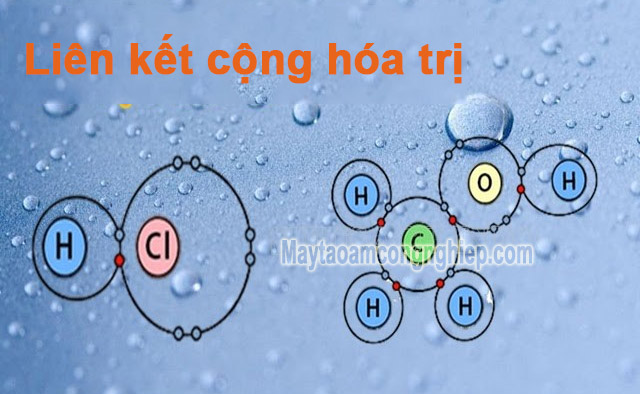
Liên kết cộng hóa trị là liên kết hóa học được tạo nên bằng việc dùng chung 1 hoặc nhiều cặp electron của nguyên tử. Lực đẩy, lực hút giữa các nguyên tử Hình như chia sẻ các e được gọi là liên kết cộng hóa trị. Mỗi cặp e chung sẽ tạo thành 1 liên kết cộng hóa trị, nó gồm 2 liên kết là liên kết phân cực và không phân cực.
- Liên kết cộng hóa trị phân cực: là sự liên kết có cặp electron chung không bằng nhau và nó bị lệch về 1 phía. Nguyên tử có độ âm điện mạnh hơn nữa thì sẽ có lực hút mạnh hơn. Do vậy, e được chia sẻ gần nguyên tử có độ âm điện cao hơn.
- Liên kết cộng hóa trị không phân cực: Là sự liên kết được tạo thành từ 2 nguyên tử của cùng 1 nguyên tố. Nó được tạo thành khi các nguyên tử chia sẻ các e bằng nhau. VD như N2, H2,…
Đặc điểm của những hợp chất có liên kết cộng hóa trị là tồn tại được ở thể lỏng, khí, rắn. Những chất có cực tan nhiều trong dung môi có cực hầu hết là những chất không cực tan trong dung môi không cực. Lưu ý, những chất chứa mối liên kết cộng hóa trị không cực đều không dẫn điện.
Liên kết ion
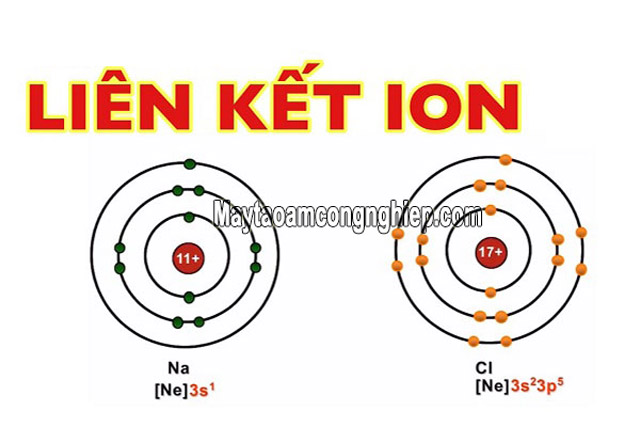
Liên kết ion là loại liên kết được tạo thành từ những nguyên tử có độ âm điện khác nhau, khi mà các e được chuyển từ nguyên tử này sang nguyên tử khác. Điều kiện cần để tạo nên liên kết ion là 2 phân tử khi phản ứng trái dấu nhau.
Liên kết này được tạo thành giữa những nguyên tử nguyên tố kim loại điển hình với nguyên tử nguyên tố phi kim điển hình. Cation là những ion mang điện tích dương (+), còn các Anion là các ion mang điện tích (-). Đặc điểm của các liên kết ion:
- Chất rắn ion là những tinh thể tồn tại được ở nhiệt độ phòng
- Hợp chất ion cứng sẽ có điểm nóng chảy và điểm sối cao.
- Khi đặt dưới áp lực, các ion dễ bị vỡ; chất rắn ion không dẫn điện còn dung dịch ion thì có thể dẫn điện.
Phương trình phân tử là gì?
Phương trình phân tử là 1 phương trình hóa học đã được cân bằng, trong đó các hợp chất ion sẽ được trình diễn dưới dạng phân tử thay vì các ion. Ví dụ:
KNO3 (aq) + HCl (aq) → KCl (aq) + HNO3 (aq)
Xem Thêm : Em thường đọc những sách gì, giải thích tại sao em lại đọc … – Hoc24
Phản ứng Oxi hóa khử nội phân tử là gì? – Phản ứng oxi hóa khử nội phân tử là dạng phản ứng, mà trong đó quá trình khử và quá trình oxi hóa xảy ra với 2 loại nguyên tố khác nhau, nhưng trong cùng 1 phân tử (nó thường là phản ứng phân hủy).
Sự khác nhau giữa nguyên tử và phân tử là gì?
Nhiều bạn vẫn thường mơ hồ về 2 khái niệm nguyên tử phân tử là gì. chính vì dưới đây chúng tôi sẽ chỉ ra một số điểm khác biệt của 2 loại này:

– Về định nghĩa: Nguyên tử là các hạt siêu nhỏ, trung hòa về điện và có thành phần gồm hạt nhân nguyên tử (gồm Proton và Notron) và vỏ nguyên tử (electron). Còn phân tử là tập hợp gồm có nhiều nguyên tử cấu tạo nên 1 chất.
– Về trạng thái tồn tại: Phân tử tồn tại ở trạng thái tự do, còn nguyên tử thì có thể hoặc không tồn tại ở trạng thái tự do.
– Về cấu tạo: Nguyên tử gồm 3 loại hạt Proton, Notron và Electron. Còn phân tử có cấu tạo gồm 2 hoặc nhiều hơn 2 nguyên tử giống nhau trong cùng 1 nguyên tố hoặc nhiều nguyên tử.
– Về hình dạng: Nguyên tử có hình cầu, còn phân tử có nhiều hình dạng như dạng góc, dạng tuyến tính, dạng chữ nhật,…
– Về bản lĩnh phản ứng: Phân tử không tham gia phản ứng hóa học, còn nguyên tử có khả năng phản ứng cao.
– Về liên kết: Phân tử có liên kết cộng hóa trị gồm liên kết đơn, đôi và ba. Còn nguyên tử mang liên kết hạt nhân, nó kéo theo lực hút tĩnh điện giữa hạt nhân và electron.
Một số khái niệm khác liên quan đến phân tử
Y sinh học phân tử là gì?

Y sinh học phân tử là lĩnh vực bát ngát, ở đây sinh học, hóa học và các kỹ thuật vật lý y học được sử dụng để mô tả cấu tạo phân tử cùng các cơ chế, xác định mức độ phân tử và việc di truyền các rối loạn cơ bản của bệnh tật ở người. Từ đó, phát triển các kỹ thuật can thiệp phân tử để sửa chữa và điều trị chúng.
Hợp chất cao phân tử là gì?
Hợp chất cao phân tử là hợp chất hữu cơ được hình thành trong thiên nhiên ngay từ những ngày đầu tồn tại của Trái Đất, ví dụ như protit (thành phần của tế bào sống); xenlulozơ (thành phần chủ yếu của thực vật),…
Di truyền phân tử là gì?

Di truyền phân tử tiếng Anh là Molecular genetics, là 1 lĩnh vực sinh học nghiên cứu cấu trúc và chức năng của gen ở cấp độ phân tử. Việc nghiên cứu nhiễm sắc thể và biểu đạt gen sẽ có được cái nhìn sâu hơn về di truyền, biến dị và đột biến sinh học. Điều này rất có ích trong việc tìm hiểu và điều trị những bệnh về di truyền.
Ẩm thực phân tử là gì?
Ẩm thực phân tử Molecular Gastronomy/ Molecular Cuisine là phương pháp nấu ăn hiện đại, cụ thể là người đầu bếp sẽ dựa trên đặc trưng chuyển đổi lý – hóa của từng nguyên liệu và ảnh hưởng tương tác &o cấu trúc nguyên liệu bằng những kỹ thuật chuyên nghiệp với mục đích tạo ra các món ăn tinh tế, độc đáo và có giá trị dinh dưỡng cao.
Bài viết trên đây chúng tôi đã tổng hợp những kiến thức về phân tử là gì và cách tính phân tử khối của chất. Hy vọng bài viết này của maytaoamcongnghiep.com sẽ giúp bạn hệ thống và củng cố kiến thức về phân tử. cảm ơn bạn đã niềm nở bài viết và hãy theo dõi chúng tôi thường xuyên để có thêm nhiều kiến thức bổ ích khác.
Nguồn: https://kengencyclopedia.org
Danh mục: Hỏi Đáp






