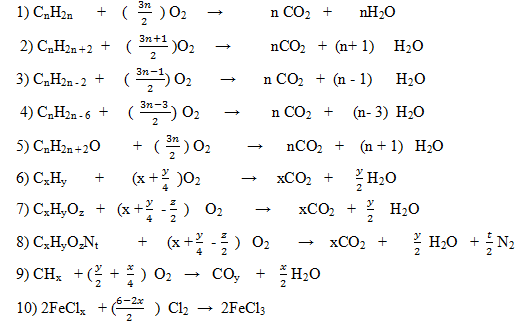Chúng tôi rất vui được chia sẻ kiến thức sâu sắc về từ khóa Phương pháp lập phương trình hóa học (có bài tập áp dụng Cơ. Bài viết cac phuong trinh hoa hoc lop 8 tập trung giải thích ý nghĩa, vai trò và ứng dụng của từ khóa này trong tối ưu hóa nội dung web và chiến dịch tiếp thị. Chúng tôi cung cấp phương pháp tìm kiếm, phân tích từ khóa, kèm theo chiến lược và công cụ hữu ích. Hy vọng thông tin này sẽ giúp bạn xây dựng chiến lược thành công và thu hút người dùng.
Phương trình hóa học biểu lộ phản ứng hóa học. Vậy làm thế nào để lập phương trình hóa học 1 cách chính xác nhất. các phương pháp hữu hiệu dưới đây sẽ giúp các em giải quyết các bài tập về lập phương trình hóa học từ cơ bản đến nâng caao 1 cách dễ dàng.
LẬP PHƯƠNG TRÌNH HÓA HỌC
Bạn Đang Xem: Phương pháp lập phương trình hóa học (có bài tập áp dụng Cơ
Phương trình hóa học biểu hiện phản ứng hóa học. Vậy làm thế nào để lập phương trình hóa học một cách chính xác nhất. Các phương pháp hữu hiệu dưới đây sẽ giúp các em giải quyết các bài tập về lập phương trình hóa học từ cơ bản đến nâng caao một cách dễ dàng.
I. HƯỚNG GIẢI.
B1: Viết sơ đồ phản ứng dưới dạng công thức hóa học.
B2: Đặt hệ số sao cho số nguyên tử của mỗi nguyên tố ở hai vế bằng nhau.
B3: Hoàn thành phương trình.
Chú ý:
– Ở B2, thường sử dụng phương pháp “Bội chung bé nhất” để đặt hệ số bằng phương pháp:
- Chọn nguyên tố có số nguyên tử ở hai vế chưa bằng nhau và có số nguyên tử nhiều nhất (cũng có trường hợp không phải vậy).
- Tìm bội chung thấp nhất của các chỉ số nguyên tử nguyên tố đó ở hai vế, đem bội chung bé nhất chia cho chỉ số thì ta có hệ số.
- Trong quá trình cân bằng không được thay đổi các chỉ số nguyên tử trong các công thức hóa học.
II. CÁC PHƯƠNG PHÁP CÂN BẰNG CỤ THỂ
1. Phương pháp “chẵn – lẻ”: thêm hệ số &o trước chất có chỉ số lẻ để làm chẵn số nguyên tử của nguyên tố đó.
VD1: Cân bằng PTHH
Al + HCl → AlCl3 + H2
– Ta chỉ việc thêm hệ số 2 &o trước AlCl3 để cho số nguyên tử Cl chẵn. Khi đó, vế phải có 6 nguyên tử
Cl trong 2AlCl3, nên vế trái thêm hệ số 6 trước HCl.
Al + 6HCl → 2AlCl3 + H2
– Vế phải có 2 nguyên tử Al trong 2AlCl3, vế trái ta thêm hệ số 2 trước Al.
2Al + 6HCl → 2AlCl3 + H2
– Vế trái có 6 nguyên tử H trong 6HCl, nên vế phải ta thêm hệ số 3 trước H2.
2Al + 6HCl → 2AlCl3 + 3 H2
VD2:
KClO3 → KCl + O2
– Ta thấy số nguyên tử oxi trong O2 là số chẵn và trong KClO3 là số lẻ nên đặt hệ số 2 trước công thức KClO3.
2KClO3 → KCl + O2
– Tiếp theo cân bằng số nguyên tử K và Cl, đặt hệ số 2 trước KCl.
2KClO3 → 2KCl + O2
– Cuối cùng cân bằng số nguyên tử oxi nên đặt hệ số 3 trước O2.
2KClO3 → 2KCl + 3O2
VD3:
Al + O2 → Al2O3
– Số nguyên tử oxi trong Al2O3 là số lẻ nên thêm hệ số 2 &o trước nó.
Al + O2 → 2Al2O3
Khi đó, số nguyên tử Al trong 2Al2O3 là 4. Ta thêm hệ số 4 &o trước Al.
4 Al + O2 → 2Al2O3
– Cuối cùng cân bằng số nguyên tử oxi, vế phải số nguyên tử oxi trong 2Al2O3 là 6, vế trái ta thêm hệ số 3 trước O2.
Xem Thêm : Tóm tắt chiến lược chiến tranh đặc biệt của Mỹ tại Việt Nam
4Al + 3O2 → 2Al2O3
2. Phương pháp “đại số”: thường sử dụng cho các phương trình khó cân bằng bắng phương pháp trên (bình thường sử dụng cho hs giỏi).
- B1: Đưa các hệ số hợp thức a, b, c, d, e, f, … lần lượt &o các công thức ở hai vế của phương trình phản ứng.
- B2: Cân bằng số nguyên tử ở 2 vế của phương trình bằng một hệ phương trình chứa các ẩn: a, b, c, d, e, f, g….
- B3: Giải hệ phương trình vừa lập để tìm các hệ số.
- B4: Đưa các hệ số vừa tìm &o phương trình phản ứng.
VD1: Cu + H2SO4 đặc, nóng → CuSO4 + SO2 + H2O (1)
- B1: aCu + bH2SO4 đặc, nóng → cCuSO4 + dSO2 + eH2O
- B2: Tiếp theo lập hệ phương trình dựa &o mối quan hệ về cân nặng giữa các chất trước và sau phản ứng, (khối lượng nguyên tử của mỗi nguyên tố ở 2 vế phải bằng nhau).
Cu: a = c (1)
S: b = c + d (2)
H: 2b = 2e (3)
O: 4b = 4c + 2d + e (4)
- B3: Giải hệ phương trình bằng phương pháp:
Từ pt (3), chọn e = b = 1 (có thể chọn bất kỳ hệ số khác).
Từ pt (2), (4) và (1) => c = a = d = ½ => c = a = d = 1; e = b =2 (tức là ta đang quy đồng mẫu số).
- B4: Đưa các hệ số vừa tìm &o phương trình phản ứng, ta được phương trình hoàn chỉnh. Cu + 2H2SO4 đặc, nóng →CuSO4 + SO2 + 2H2O
III. BÀI TẬP VẬN DỤNG
Bài 1
Cân bằng các PTHH sau :
1) MgCl2 + KOH → Mg(OH)2 + KCl 2) Cu(OH)2 + HCl → CuCl2 + H2O 3) Cu(OH)2 + H2SO4 → CuSO4 + H2O 4) FeO + HCl → FeCl2 + H2O 5) Fe2O3 + H2SO4 → Fe2 (SO4)3 + H2O 6) Cu(NO3)2 + NaOH → Cu(OH)2 + NaNO37) P + O2 → P2O5 8) N2 + O2 → NO 9) NO + O2 → NO210) NO2 + O2 + H2O → HNO311) SO2 + O2 → SO312) N2O5 + H2O → HNO313) Al2(SO4)3 + AgNO3 → Al(NO3)3 + Ag2SO414) Al2 (SO4)3 + NaOH → Al(OH)3 + Na2SO415) CaO + CO2 → CaCO316) CaO + H2O → Ca(OH)217) CaCO3 + H2O + CO2 → Ca(HCO3)2 18) Na + H3PO4 → Na2HPO4 + H219) Na + H3PO4 → Na3PO4 + H220) Na + H3PO4 → NaH2PO4 + H221) C2H2 + O2 → CO2 + H2O 22) C4H10 + O2 → CO2 + H2O 23) C2H2 + Br2 → C2H2Br424) C6H5OH + Na → C6H5ONa + H225) CH3COOH+ Na2CO3 → CH3COONa + H2O + CO2
26) CH3COOH + NaOH → CH3COONa + H2O 27) Ca(OH)2 + HBr → CaBr2 + H2O 28) Ca(OH)2 + HCl → CaCl2 + H2O 29) Ca(OH)2 + H2SO4 → CaSO4 + H2O 30) Ca(OH)2 + Na2CO3 → CaCO3 + NaOH 31) Na2S + H2SO4 → Na2SO4 + H2S 32) Na2S + HCl → NaCl + H2S 33) K3PO4 + Mg(OH)2 → KOH + Mg3 (PO4)234) Mg + HCl → MgCl2 + H2 35) Fe + H2SO4 → FeSO4 + H236) Al(OH)3 + H2SO4 → Al2(SO4)3 + H2O 37) Al(OH)3 + HCl → AlCl3 + H2O 38) KMnO4 → K2MnO4 + MnO2 + O239) MnO2 + HCl → MnCl2 + Cl2 + H2O 40) KNO3 → KNO2 + O241) Ba(NO3)2 + H2SO4 → BaSO4 + HNO342) Ba(NO3)2 + Na2SO4 → BaSO4 + NaNO343) AlCl3 + NaOH → Al(OH)3 + NaCl 44) Al(OH)3 + NaOH → NaAlO2 + H2O 45) KClO3 → KCl + O245) Fe(NO3)3 + KOH → Fe(OH)3 + KNO346) H2SO4 + Na2CO3 → Na2SO4 + H2O + CO247) HCl + CaCO3 → CaCl2 + H2O + CO248) Ba(OH)2 + HCl → BaCl2 + H2O 49) BaO + HBr → BaBr2 + H2O 50) Fe + O2 → Fe3O4
Bài 2
Cho sơ đồ của các phản ứng sau:
a) Na + O2 → Na2O b) P2O5 + H2O → H3PO4
c) HgO → Hg + O2 d) Fe(OH)3 → Fe2O3 + H2O
Lập PTHH và cho biết tỉ lệ số nguyên tử, số phân tử của các chất trong mỗi phản ứng.
Bài 3
Cho sơ đồ phản ứng
a) NH3 + O2 → NO + H2O
b) S + HNO3 → H2SO4 + NO
c) NO2 + O2 + H2O → HNO3
d) FeCl3 + AgNO3 → Fe(NO3)3 + AgCl
e) NO2 + H2O → HNO3 + NO
f) Ba(NO3)2 + Al2(SO4)3 → BaSO4 + Al(NO3)3
Hãy lập PTHH và cho biết tỉ lệ số nguyên tử, phân tử các chất trong mỗi phản ứng.
Bài 4 (*)
Lập phương trình hóa học của các phản ứng sau:
1) CnH2n + O2 → CO2 + H2O
2) CnH2n + 2 + O2 → CO2 + H2O
3) CnH2n – 2 + O2 → CO2 + H2O
4) CnH2n – 6 + O2 → CO2 + H2O
5) CnH2n + 2O + O2 → CO2 + H2O
6) CxHy + O2 → CO2 + H2O
Xem Thêm : Đáp án đi tìm Heo Thông Thái Thu thập huy hiệu nghề
7) CxHyOz + O2 → CO2 + H2O
8) CxHyOzNt + O2 → CO2 + H2O + N2
9) CHx + O2 → COy + H2O
10) FeClx + Cl2 → FeCl3
IV. LỜI GIẢI
Bài 1.
1) MgCl2 + 2KOH → Mg(OH)2 + 2KCl 2) Cu(OH)2 + 2HCl → CuCl2 + 2H2O 3) Cu(OH)2 + H2SO4 → CuSO4 + 2H2O 4) FeO + 2HCl → FeCl2 + H2O 5) Fe2O3 + 3H2SO4 → Fe2 (SO4)3 + 3H2O 6) Cu(NO3)2 + 2NaOH → Cu(OH)2 + 2NaNO37) 4P + 5O2 → 2P2O5 8) N2 + O2 → 2NO 9) 2NO + O2 → 2NO210) 4NO2 + O2 + 2H2O → 4HNO311) 2SO2 + O2 → 2SO312) N2O5 + H2O → 2HNO313) Al2(SO4)3 + 6AgNO3 → 2Al(NO3)3 + 3Ag2SO414) Al2 (SO4)3 + 6NaOH → 2Al(OH)3 + 3Na2SO415) CaO + CO2 → CaCO316) CaO + H2O → Ca(OH)217) CaCO3 + H2O + CO2 → Ca(HCO3)2 18) 2Na + H3PO4 → Na2HPO4 + H219) 6Na + 2H3PO4 → 2Na3PO4 + 3H220) 2Na + 2H3PO4 → 2NaH2PO4 + H221) 2C2H2 + 5O2 → 4CO2 + 2H2O 22) 2C4H10 + 13O2 → 8CO2 + 10H2O 23) C2H2 + 2Br2 → C2H2Br424) 2 C6H5OH + 2Na → 2C6H5ONa + H225) CH3COOH+ Na2CO3 → CH3COONa + H2O + CO2
26) CH3COOH + NaOH → CH3COONa + H2O 27) Ca(OH)2 + 2HBr → CaBr2 + 2H2O 28) Ca(OH)2 + 2HCl → CaCl2 + 2H2O 29) Ca(OH)2 + H2SO4 → CaSO4 + 2 H2O 30) Ca(OH)2 + Na2CO3 → CaCO3 + 2NaOH 31) Na2S + H2SO4 → Na2SO4 + H2S 32) Na2S + 2HCl → 2NaCl + H2S 33) 2K3PO4 + 3Mg(OH)2 → 6KOH + Mg3 (PO4)234) Mg + 2HCl → MgCl2 + H2 35) Fe + H2SO4 → FeSO4 + H236) 2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O 37) 2Al(OH)3 + 6HCl → 2AlCl3 + 6H2O 38) 2KMnO4 → K2MnO4 + MnO2 + O239) MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O 40) 2KNO3 → 2KNO2 + O241) Ba(NO3)2 + H2SO4 → BaSO4 + 2HNO342) Ba(NO3)2 + Na2SO4 → BaSO4 + 2NaNO343) AlCl3 + 3NaOH → Al(OH)3 + 3NaCl 44) 2Al(OH)3 + 2NaOH → 2NaAlO2 + 4H2O 45) 2KClO3 → 2KCl + 3O245) Fe(NO3)3 + 3KOH → Fe(OH)3 + 3KNO346) H2SO4 + Na2CO3 → Na2SO4 + H2O + CO247) 2HCl + CaCO3 → CaCl2 + H2O + CO248) Ba(OH)2 + HCl → BaCl2 + 2H2O 49) BaO + 2HBr → BaBr2 + H2O 50) 3Fe + 2O2 → Fe3O4
Bài 2.
a) 4Na + O2 → 2Na2O
Tỉ lệ: số nguyên tử Na: số phân tử O2: số phân tử Na2O = 4 : 1 : 2.
b) P2O5 + 3H2O → 2H3PO4
Tỉ lệ: Số phân tử P2O5 : số phân tử H2O: số phân tử H3PO4 = 1 : 3 : 2.
c) 2HgO → 2Hg + O2
Tỉ lệ: số phân tử HgO: số nguyên tử Hg: số phân tử O2 = 2 : 2 : 1.
d) 2Fe(OH)3 → Fe2O3 + 3H2O
Tỉ lệ: số phân tử Fe(OH)3 : số phân tử Fe2O3 : số phân tử H2O = 2 : 1 : 3.
Bài 3
a) 4NH3 + 5O2 → 4NO + 6H2O
Tỉ lệ: 4: 5: 4: 6
b) S + 2HNO3 → H2SO4 + 2NO
Tỉ lệ: 1: 2: 1: 2
c) 4NO2 + O2 + 2H2O → 4HNO3
Tỉ lệ: 4: 1: 2: 4
d) FeCl3 + 3AgNO3 → Fe(NO3)3 + 3 AgCl
Tỉ lệ: 1: 3: 1: 3
e) 3NO2 + H2O → 2HNO3 + NO
Tỉ lệ: 3: 1: 2: 1
f) 3Ba(NO3)2 + Al2(SO4)3 → 3BaSO4 + 2Al(NO3)3
Tỉ lệ: 3 : 1: 3: 2
Bài 4 (*)
Tất cả nội dung bài viết. Các em hãy tham khảo và tải file chi tiết dưới đây:
Tải về
Luyện Bài tập trắc nghiệm môn Hóa lớp 8 – Xem ngay
Nguồn: https://kengencyclopedia.org
Danh mục: Hỏi Đáp